上海证券报消息,居家自测新冠肺炎或将实现?
3月11日,国家卫健委官网发布通知称,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组3月10日已印发《关于印发新冠病毒抗原检测应用方案(试行)的通知》,显示国家将在核酸检测基础上,增加抗原检测作为补充。根据方案,社区居民有自我检测需求的,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测。

受上述信息提振,3月11日,新冠肺炎疫情检测概念股午后齐拉升,创业板股万孚生物、兰卫医学2连板。截至收盘,九安医疗、明德生物等股涨停,东方生物、硕世生物、热景生物涨超10%。

哪些人群适用抗原检测?
《方案》规定了抗原检测的适用人群:
一是到基层医疗卫生机构就诊,伴有呼吸道、发热等症状且出现症状5天以内的人员;
二是隔离观察人员,包括居家隔离观察、密接和次密接、入境隔离观察、封控区和管控区内的人员;
三是有抗原自我检测需求的社区居民。
同时,《方案》明确了3类人群进行抗原检测需满足的主要条件、检测试剂的获得渠道,制定了检测发现阳性后的处置管理流程,促进抗原检测与核酸检测相衔接。
为便于各地规范开展检测,《方案》还包括2个附件,即基层医疗卫生机构新冠病毒抗原检测基本要求及流程、新冠病毒抗原自测基本要求及流程。
需要说明的是,核酸检测依然是新冠病毒感染的确诊依据,抗原检测作为补充手段可以用于特定人群的筛查,有利于提高“早发现”能力。基层医疗卫生机构具有核酸检测能力的,应当首选核酸检测;不具备核酸检测能力的,可以进行抗原检测,并做好医务人员的培训和患者的沟通指导。隔离观察人员和社区居民进行抗原检测,应当认真阅读说明书、规范操作,一旦抗原检测阳性要立即向有关部门报告;需要时,进行核酸检测予以确认。
有业内人士分析,该通知的出台,意味着国内疫情防控呈现出放开之势,接下来得做好全面迎接“后疫情时代”常态化的准备。尤其是基层的医疗机构,将真正成为疫情防控的哨点。
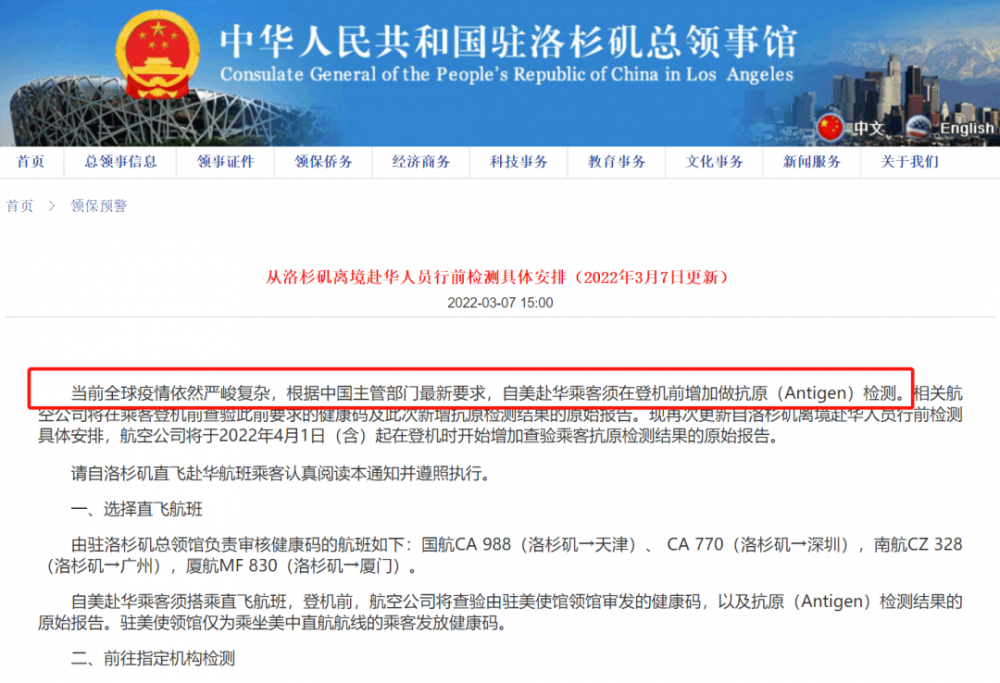
另外,近日,中国驻洛杉矶总领事馆在官网发布新的通知显示,根据中国主管部门最新要求,自美赴华乘客须在登机前增加做抗原(Antigen)检测。相关航空公司将在乘客登机前查验此前要求的健康码及此次新增抗原检测结果的原始报告。
据通知,中国驻美国使馆、驻纽约总领馆、驻旧金山总领馆、驻洛杉矶总领馆、驻芝加哥总领馆将分别就各自领区内赴华直飞航班,公布有关抗原检测安排。
测获取结果不超过30分钟 成本约为核酸检测的20%
新冠检测主要有核酸、抗体、抗原三种检测方法。
记者从多方获悉,检测病原体既可以检测抗原,也可以检测核酸。核酸检测对实验室环境、检测人员、仪器要求高,检测灵敏度高、特异性好,一般2至3小时可以出结果。
抗原检测是通过鼻咽拭子样本寻找病毒的RNA。
比较三种新冠病毒检测手段来看,抗原检测可以直接检测病毒感染情况,对实验室要求低,可用于早筛查、早诊断,最快15分钟以内出结果,适合基层医院大规模筛查。
从全球来看,欧美国家很早就开始使用这种检测方法,在中国香港地区,这种检测方法也起到了重要作用。
今年全国两会期间,全国政协委员、重庆医科大学校长黄爱龙公开呼吁,建议尽早构建“以居家自测为主的大规模抗原快速检测+有针对性的小范围精准核酸检测”相结合的常态化疫情防控模式。
黄爱龙认为,与核酸检测、抗体检测相比,抗原快速检测具备操作简便、快捷高效、适用广泛、成本低廉、安全可靠等诸多优势,可以极大减轻医护人员、医疗卫生机构负担。同时,抗原快速检测获取结果不超过30分钟,试剂成本约为核酸检测的20%,若组织有力,短时间内可以在各种会议、体育赛事等大型活动中完成超大规模人群的筛查。若将两种检测方式相结合,可以极大地提高疫情防控效率,还可以大幅降低疫情防控成本,减少因疫情防控对经济发展带来的限制和影响。
抗原自测在国内或将加快审批报证
值得一提的是,根据国家药监局政务门户,NMPA又批准了一款新冠抗原检测试剂盒,拿证的是北京华科泰生物技术股份有限公司,方法学是荧光免疫层析法。

这是时隔15个月后,国内批准的第4款新冠抗原检测试剂盒。这同时被业内解读为一个巨大的信号,有业内人士对记者表示,抗原自测在国内或将加快审批报证。
根据国家药监局官方数据显示,此前获批的三家分别为万孚生物、北京金沃夫生物工程科技有限公司和华大基因旗下深圳华大因源医药科技有限公司的产品。


来源:安信证券
中泰证券研报指,目前国内已有上百家体外诊断生产企业的新冠抗原自检试剂盒在海外注册获批,欧洲、马来西亚等地区市场竞争日益激烈。其中,东方生物、热景生物、九安医疗、艾康生物、圣湘生物、亚辉龙等为代表的中国体外检测企业在海外订单需求较为旺盛。在产量上,东方生物、艾康生物此前都公开表示日产量超过1000万人份。
近日,抗原检测公司发布的业绩预告均提到受益于海外对新冠抗原检测试剂需求的大幅增加,公司订单和收入大幅增长。
热景生物预计2021年年度实现归母净利润20.0亿元至23.5亿元,同比增加1684.65%至1996.97%。东方生物预计2021年年度实现归母净利润47.2亿元至51.2亿元,同比增加181.45%至205.31%。博拓生物预计2021年年度实现归母净利润8.1亿元至9.1亿元,同比增加86.14%至109.12%。奥泰生物预计2021年年度实现归母净利润7.15亿元至7.95亿元,同比增加3.78%至17.05%。
有相关企业工作人员对记者表示,尽管目前新冠检测产品布局厂商众多,但是获得NMPA和CE双认证的厂商数量并不多,且彼此产能也存在较大差异,龙头效应依然显著(尤其在海外出口方面),产品性能卓越、产能具有优势的厂商预计将占据较高的市场份额。
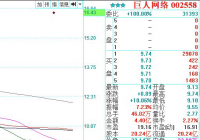
检测概念股齐拉升 万孚生物20cm涨停!
抗原检测的呼声在市场引起了巨大反响。
3月11日,新冠肺炎检测概念股齐拉升。统计显示,3月11日,Wind新冠肺炎检测指数涨幅超过8%。

高志刚制表
个股方面,万孚生物以“20cm”涨停收盘。东方生物涨幅也超过18%,硕世生物涨幅超过12%,热景生物涨幅超过11%。
一位来自生物医药企业的行业人士对上海证券报记者表示,如果采用抗原检测,可以理解为对现在核酸检测的一种有效补充。对那些抗体阳性(按现在单一检测抗体,阳性需要隔离的人)但抗原阴性的人,就不需要进行隔离了。这是对现有政策一种更精准的防控。
“如果抗原检测能推广,对市场来说,这意味着做抗原检测的公司将多了一块市场需求。”一位证券行业人士对记者说。
天风证券认为,国内抗原检测具有产品成熟、产能供应充足、特定的应用场景需要抗原检测快速反应等优点,有望成为完善常态化防控和突发疫情应急处置机制重要补充手段。
推动新冠肺炎治疗药物落地
与此同时,一则来自辉瑞公司的信息,也让市场对精准防控有了新认识。

3月9日,辉瑞公司同通用技术中国医药健康产业股份有限公司(简称“通用技术中国医药”)共同宣布,就新冠肺炎病毒治疗药物奈玛特韦片/利托那韦片组合包装(即PAXLOVID)签订供应协议。通用技术中国医药将在协议期内负责辉瑞公司新冠病毒治疗药物PAXLOVID在中国大陆市场的商业运营。
此前,国家药品监督管理局根据药品管理法相关规定,按照药品特别审批程序,进行了应急审评审批,附条件批准辉瑞新冠肺炎病毒治疗药物PAXLOVID的进口注册。
PAXLOVID为口服小分子新冠肺炎病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。
“我们非常荣幸可以同通用技术中国医药合作,支持中国政府和人民,积极应对这一公共卫生危机。”辉瑞生物制药集团中国区总裁彭振科表示,“辉瑞公司将坚定地支持中国应对现有及未来可能面对的医疗健康挑战,助力‘健康中国2030’宏伟愿景的实现。”
通用技术集团总经理助理,通用技术中国医药董事长、党委书记李亚东表示:“此次合作,双方将依托双方资源优势,全力推进新冠肺炎治疗药物的落地,让中国患者与国际共享原研成果。”
原标题:重磅!国家卫健委:增加新冠病毒抗原检测,居民可购买试剂自测!“新冠检测概念股”提前大涨!谁能用、怎么用、哪些企业受益?
【免责声明】上游新闻客户端未标有“来源:上游新闻”或“上游新闻LOGO、水印的文字、图片、音频视”等稿件均为转载稿。如转载稿涉及版权等问题,请联系上游。