生命个体为什么会衰老?不同生物为什么衰老的速度不同?这是人类有思考以来不能回避的问题。佛曰人生苦,衰老七之二;庄子感夏虫,今生不语冰。古今中外,多少至圣贤哲,为生命的奇妙而赞叹;同时也为生命无奈的老去而感伤。
时光冉冉,转眼到了二十一世纪。我们了解了生命的遗传基础;生命活动的能量来源;和多种疾病的分子机理和治疗方法。对生命的衰老也开始在基因水平有了研究。
在衰老领域走在前列的是以秀丽线虫为模式动物的研究。其中里程碑的发现是谷歌Calico的研发副总裁Cynthia Kenyon在1993年发表的一个胰岛素类似蛋白的单基因突变可以大幅延长线虫的寿命,从而奠定了衰老的遗传基础。后续工作又发现生殖系统缺失,线粒体质量控制加强,和能量摄取减少都能够延长线虫的寿命。这些在线虫中对寿命延长的结论在其他动物包括哺乳类动物很多都是保守的。
然而,为什么以上这些功能的改变可以延缓衰老?衰老是否开始于某个器官,某个细胞,还是某个生化通路?这些问题目前还不清楚。所以针对衰老是否可以开发出特异抗衰老的药物,目前仍然如徐福要寻找的仙山那么飘渺。虽然很多人根据科学文献的一鳞半爪,通过节食,喝红酒(里面的白藜芦醇)和吃二甲双胍来试图延缓衰老,但是,是否有效还没有翔实的科学证据。
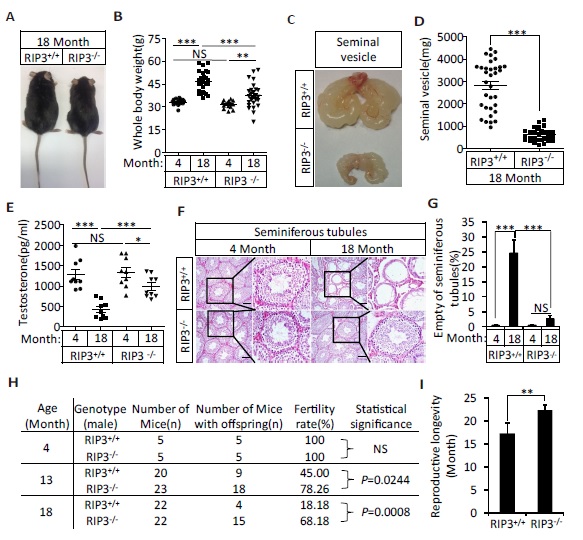
在8月15日上线的eLIFE杂志上,北京生命科学研究所王晓东实验室发表了他们实验室的最新论文,讲述了在老鼠上发现了控制雄性生殖系统衰老的信号通路。并且,王晓东实验室同北生所张志远实验室,共同开发了针对这一衰老通路的一个关键激酶的小分子化合物,通过长期喂含有此化合物食物的小鼠,取得了阻断小鼠雄性生殖系统衰老的效果。
当吃正常食物的对照组小鼠基本丧失生育能力后,吃药的小鼠的生育能力基本保持不变。解剖结果显示,喂药的老的小鼠和年轻小鼠的组织器官基本一致,雄性荷尔蒙水平得以维持,衰老相关的症状,如体重增加,毛发稀疏,不再出现。
据目前所知,这是第一个在哺乳类动物中所发现的,在分子,细胞,器官,和整体动物水平上完整描述的衰老通路。
像很多科学上重要的发现一样,该衰老通路的发现过程也充满了偶然性。
王晓东实验室过去没有专门研究过衰老。他们二十几年的研究一直注重在细胞程序性死亡:早期,多专注细胞凋亡;近来更着力于一种细胞程序性坏死过程。他们发现这种细胞死亡是由细胞膜结合激酶RIPK3和它的底物MLKL来执行的。RIP3在执行由肿瘤坏死因子诱导的死亡过程中需要由一相似激酶RIP1来激活;激活的RIP3又通过磷酸化MLKL而使MLKL激活;激活后的MLKL寡聚化后在细胞膜上打孔,引起细胞死亡。
在一项和衰老完全无关的研究中,他们实验室的博士生孟令君同学发现缺失RIP3基因的雄性小鼠在高龄后生殖系统明显衰老症状没有出现。这项发现当时大家虽然觉得很有意思,但随后的几年也没有引起他们的重视。其主要因素是如何才能找到分子机理当时不明朗。
这个课题在李典镕同学加入实验室后走上了快车道。他和孟令君以及另一位动物专家徐涛合作,发现MLKL缺失的小鼠有同样的表型。
他们还在正常衰老的老鼠睾丸生殖干细胞上检测到了RIP3特异激活MLKL的磷酸化信号。然后,他们给年轻小鼠的睾丸内打了一针特异诱导RIP1/RIP3/MLKL激活的试剂,发现可以引起生殖系统早衰。
最后他们和张志远实验室合作,共同开发了RIP1的抑制剂,在小鼠生殖系统将要衰老的时间开始给小鼠喂药,结果阻断了整个生殖系统的衰老。
尽管RIP3和MLKL缺失与喂RIP1抑制剂的雄小鼠能有更长的生殖能力,但它们在进入老年后,所生下的后代与年轻雄鼠的后代比多出很多缺陷:有着比例很高的出生前和出生后的死亡率。动物生殖系统衰老,会有效地把雄鼠由年老而积累了损伤的生殖细胞(精子)从种群繁殖中剔除出去,从而保障种群的进化活力。所以,该程序性衰老对动物种群健康有着重要作用。
目前,人类是唯一把生殖活动和生殖分开的生物。如果该生殖衰老通路在小鼠和人之间是保守的,那么,我们可以通过阻断该衰老通路从而保持男性生殖活力和预防如前列腺增生等由衰老所带来的男性疾病。将对整个人类的健康有重要作用和意义。
原标题:王晓东实验室解码雄性生殖系统衰老之谜
【免责声明】上游新闻客户端未标有“来源:上游新闻-重庆晨报”或“上游新闻LOGO、水印的文字、图片、音频视频等稿件均为转载稿。如转载稿涉及版权等问题,请与上游新闻联系。